Monofluorsilan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
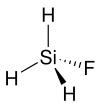 | ||||||||||||||||
| Keile zur Verdeutlichung der Geometrie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Monofluorsilan | |||||||||||||||
| Andere Namen | Fluorsilan | |||||||||||||||
| Summenformel | SiH3F | |||||||||||||||
| Kurzbeschreibung | farbloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 50,11 g·mol−1 | |||||||||||||||
| Aggregatzustand | gasförmig | |||||||||||||||
| Dichte | 2,048 g·l−1[1] | |||||||||||||||
| Schmelzpunkt | −98,6 °C[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Monofluorsilan ist eine chemische Verbindung aus der Gruppe der Silane.
Gewinnung und Darstellung
Monofluorsilan kann durch Reaktion von Fluormethan mit Silicium[4] oder Reaktion von Silylmethylether mit Bortrifluorid[5] oder Reaktion von Monochlorsilan mit Antimon(III)-fluorid gewonnen werden.[6]
Eigenschaften
Monofluorsilan ist ein farbloses Gas.[1] Es besitzt als Feststoff bei 96 K eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2)Vorlage:Raumgruppe/14.2 und geht bei Normaldruck direkt in den gasförmigen Zustand über.[7]
Verwendung
Monofluorsilan kann zur Herstellung von Siliciumschichten verwendet werden.[8]
Einzelnachweise
- ↑ a b c William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2016, ISBN 978-1-4398-8050-0, S. 87 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 179 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Han-Gook Cho: Investigation of Reaction Paths from Si + CH4 to C + SiH4 and from Si + CH3F to C + SiH3F: Intrinsic Reaction Coordinate Studies. In: Journal of the Korean Chemical Society. 60, 2016, S. 149, doi:10.5012/jkcs.2016.60.2.149.
- ↑ Advances in Inorganic Chemistry and Radiochemistry. Academic Press, 1961, ISBN 978-0-08-057852-1, S. 236 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ C. C. Addison: Inorganic Chemistry of the Main-Group Elements. Royal Society of Chemistry, 1973, ISBN 978-0-85186-752-6, S. 188 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. J. Blake, E. A. V. Ebsworth, S. G. D. Henderson, A. J. Welch: Structure of silyl fluoride, SiH3F, at 96 K. In: Acta Crystallographica Section C Crystal Structure Communications. 41, S. 1141, doi:10.1107/S0108270185006904.
- ↑ Akihisa Matsuda, Kiyoshi Yagii, Takao Kaga, Kazunobu Tanaka: Glow-Discharge Deposition of Amorphous Silicon from SiH3F . In: Japanese Journal of Applied Physics. 23, 1984, S. L576, doi:10.1143/JJAP.23.L576.











