Diisopropylamidure de lithium
| Diisopropylamidure de lithium | |
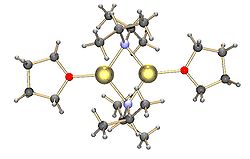 | |
| Dimère de LDA avec les atomes de lithium coordinés par du THF | |
| Identification | |
|---|---|
| Nom UICPA | Diisopropylamidure de lithium |
| Synonymes | LDA |
| No CAS | 4111-54-0 |
| No ECHA | 100.021.721 |
| No CE | 223-893-0 |
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule | C6H14LiN [Isomères] |
| Masse molaire[2] | 107,123 ± 0,008 g/mol C 67,27 %, H 13,17 %, Li 6,48 %, N 13,08 %, |
| pKa | 36 (in THF) [1] |
| Propriétés physiques | |
| Solubilité | Soluble dans les éthers, les alcanes, ou le toluène. Décomposition dans l'eau. |
| Masse volumique | 0,79 |
| Précautions | |
| SGH[3] | |
  Danger H250 : S'enflamme spontanément au contact de l'air H314 : Provoque de graves brûlures de la peau et des lésions oculaires P222 : Ne pas laisser au contact de l’air. P231 : Manipuler sous gaz inerte. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P322 : Mesures spécifiques (voir … sur cette étiquette). P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. P410 : Protéger du rayonnement solaire. | |
| Unités du SI et CNTP, sauf indication contraire. | |
modifier  | |
Le diisopropylamidure de lithium (noté LDA de l'anglais Lithium diisopropylamide) est un composé très utilisé en chimie organique de formule brute C6H14LiN. Ce composé de formule LiN[CH(CH3)2]2 est un amidure substitué. En solution, il se comporte comme une base forte (pKa d'environ 36) et très encombrée de telle sorte qu'il ne s'additionne pas (mauvais nucléophile) aux dérivés carbonylés.
Le LDA est préparé à partir de la diisopropylamine et du butyllithium[4]. Il est soluble dans les solvants organiques comme le THF et garde une très bonne réactivité à −78 °C.
Utilisations
Le diisopropylamidure de lithium sert en chimie organique pour favoriser les réactions d'élimination. Le LDA est aussi utilisé comme base pour la préparation de l'ion énolate par déprotonation d'énol ou de cétone énolisable (c'est-à-dire qui possède au moins un hydrogène sur le carbone en alpha).
Avantages par rapport au n-butyllithium
Alors que le n-butyllithium se montre très nucléophile à partir d'une certaine température, le LDA est beaucoup moins nucléophile tout en étant stable. C'est donc un réactif de choix dans certaines réactions.
Notes et références
- ↑ " Evan's pKa Table
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ " Fiche de sécurité établie par Sigma-Aldrich, consultée le 05/01/2020
- ↑ Jacques Drouin, Introduction à la chimie organique : Les molécules organiques dans votre environnement. Usages, toxicité, synthèse et réactivité, Corbas (Rhône), Librairie du Cèdre, , 22e éd., 785 p. (ISBN 978-2-916346-00-7, OCLC 421344172, BNF 40102520), p. 509
Articles connexes
 Portail de la chimie
Portail de la chimie








