ヘマグルチニン
タンパク質構造のイメージ
ヘマグルチニン(hemagglutinin、haemagglutinin、HA)とは、インフルエンザウイルス、およびその他多くの細菌、ウイルスの表面上に存在する抗原性糖タンパク質である。ヘムアグルチニンとも表記される。
ヘマグルチニンという単語は、in vitroにおいて赤血球(hem)を固まらせて凝集(英語版)体(agglutinate)を作ることから名付けられた[1]。
サブタイプ
ヘマグルチニン(以下HA)は少なくとも16種類が存在する。これらのサブタイプはH1からH16の種類に分けられる。インフルエンザウイルスの亜型名(例:H5N1など)のHはこのHAの種類を表している(Nはノイラミニダーゼの種類を表す)。最後に発見されたH16は、最近スウェーデンとノルウェーからのユリカモメから分離された例のみである[2]。また、グアテマラにおいてコウモリから発見されたヘマグルチニンは今まで知られているものいずれとも構造が異なるため、これをH17とすることが提案されている[3]。H1、H2、H3の3種類はヒトインフルエンザウイルスに存在する。
H5N1(トリインフルエンザ:avian flu)は極まれにヒトにも感染する可能性がある。ヒトの患者から発見されたトリインフルエンザウイルスのH5はアミノ酸配列が1つ変異していた。そのため、H5N1ウイルスのレセプター特性が変化してヒトにも感染するようになったということが発表された[4][5]。この発見は通常ヒトには感染しないH5N1ウイルスがどのようにしてヒトの細胞に感染するのかを的確に説明できる。
また、このH5N1ウイルスのHA抗原の変異が高い病原性の原因にもなっていることがわかった。これはプロテアーゼによる活性型への転換が容易になったためである。
機能とメカニズム
機能

HAには重要な機能が2つある。
メカニズム
HAは標的細胞表面のシアル酸に結合する。そのため、ウイルスが細胞表面から離れなくなる。ウイルスはそのまま細胞膜に包み込まれ、ウイルスを入れたままエンドソームの形で細胞内に取り込まれる。
次に細胞はエンドソーム内部を酸化させ、ウイルスをリソソームに送り込んで消化しようとする。しかし、エンドソームのpHが6.0まで低下するとHAの構造は不安定になり、折りたたまれたペプチド構造が部分的に展開する。するとタンパク質で隠されていた強疎水性の部位が開放される。
この融合ペプチド(fusion peptide)を、あたかも鉤のようにエンドソーム膜に挿入して固定する。さらに、HA分子の残りの部分は新しい構造(より低いpHでも安定な構造)に折りたたみ直され、融合ペプチドを引き寄せる。するとウイルス自身もエンドソーム膜に引き寄せられ、膜と融合する。
その後、ウイルスのRNAは細胞質に挿入されて増殖を開始する。(PDB今月の分子:赤血球凝集素(2006年4月)も参照)
構造

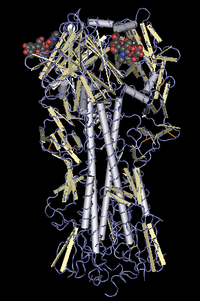
HAはホモ3量体の重要な膜糖タンパク質である。シリンダーのような形をしており、長さはおよそ135 Åである。
HAを構成する同一の3つのモノマーは中心部にαヘリックスを持っており、この頭部にシアル酸結合部位がある。HAのモノマーはまず前駆体が合成される。この前駆体は後にグリコシル化されて分裂され、HA1とHA2の2つのサブユニットになる。
それぞれのHAモノマーは、膜にくっ付いた長いヘリックス鎖で構成されている。
出典
- ^ Nelson DL and Cox MM, 2005. Lehninger's Principles of Biochemistry, 4th edition, WH Freeman, New York, NY.
- ^ Fouchier RAM, Munster V, Wallensten A, et al, 2005. Characterization of a novel influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls. J Virol vol 79, issue 5, pp2814-22
- ^ Suxiang T. et al. 2012. A distinct lineage of influenza A virus from bats. Proc Natl Acad Sci USA 109 : 4269–4274
- ^ Suzuki, Y, 2005. Sialobiology of Influenza: Molecular Mechanism of Host Range Variation of Influenza Viruses in Biological and Pharmaceutical Bulletin, (2005) vol 28, No.3, pp399-408
- ^ Gambaryan A, Tuzikov A, Pazynina G, Bovin N, Balish A, Klimov A, 2006. Evolution of the receptor binding phenotype of influenza A (H5) viruses in Virology vol 344, issue 2, pp432-8
参考文献
- Yamada S, Suzuki Y, Suzuki T, et al, 2006 Haemagglutinin mutations responsible for the binding of H5N1 influenza A viruses to human-type receptors. Nature vol 444, issue 7117, pp378-82.
- Hatta M, Gao P, Halfmann P, Kawaoka Y, 2001. Molecular Basis for High Virulence of Hong Kong H5N1 Influenza A Viruses in Science vol 293, pp1840-1842.
- Senne DA, Panigrahy B, Kawaoka Y, Pearson JE, Suss J, Lipkind M, Kida H, Webster RG, 1996. Survey of the hemagglutinin (HA) cleavage site sequence of H5 and H7 avian influenza viruses: amino acid sequence at the HA cleavage site as a marker of pathogenicity potential in Avian Disease vol 40, pp425-437.
- Weis WI, Brünger AT, Skehel JJ, et al, 1990. Refinement of the influenza virus hemagglutinin by simulated annealing. J Mol Biol vol 212, pp737-761.
- White JM, Hoffman LR, Arevalo JH, et al, 1997. Attachment and entry of influenza virus into host cells. Pivotal roles of hemagglutinin. In Structural Biology of Viruses. Chiu W, Burnett RM, and Garcea RL, editors. Oxford University Press, NY. pp80-104.
関連項目
外部リンク
- 76: 赤血球凝集素(Hemagglutinin) - 今月の分子 - PDBj入門
- Jmol tutorial of influenza hemagglutinin structure and activity.(英語)






