Ammonium bromida
 | |
 | |
| Nama | |
|---|---|
| Nama IUPAC Ammonium bromide | |
| Pengecam | |
No. Pendaftaran CAS |
|
Imej model 3D Jmol |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.031.973 |
| Nombor EC |
|
PubChem CID |
|
| Nombor RTECS |
|
| UNII |
|
CompTox Dashboard (EPA) |
|
InChI
| |
SMILES
| |
| Sifat | |
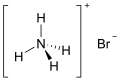
Formula kimia | NH4Br |
| Rupa bentuk | serbuk kubik yang berwarna putih atau tidak berwarna |
| Ketumpatan | 2.429 g/cm³ |
| Takat lebur | 452°C (845.6°F) |
| Takat didih | 396°C (744.8°F) |
Keterlarutan dalam air | 78.3g/100g, 25°C |
| Keasidan (pKa) | <7 |
| Struktur | |
| Struktur kristal | kubik |
| Bahaya | |
| NFPA 704 (berlian api) |  0 2 0 |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| Rujukan kotak info | |
Ammonium bromida ialah sejenis serbuk kubik yang berwarna putih. Ammonium bromida boleh larut dalam air, alkohol, aseton dan sedikit larut dalam eter. Ia digunakan dalam ubat penenang farmasi, pemekaan fotografi, dan lain-lain.
Penyediaan
Ammonium bromida boleh dibentuk melalui tindak balas ammonia dan hidrogen bromida.[1]
Ia juga boleh dibentuk melalui tindak balas bromin dan ammonia secara langsung.[2]
Ia juga boleh dibentuk melalui tindak balas ammonia dan ferum(II) bromida.[2]












