Arseen(III)fluoride
| Arseen(III)fluoride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
 | ||||
Formule van | ||||
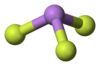 | ||||
Model van | ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Arseen(III)fluoride | |||
| Andere namen | Arseentrifluoride, trifluorarsaan, TL-156 | |||
| Molmassa | 131,9168 g/mol | |||
| SMILES | F[As](F)F | |||
| InChI | 1/AsF3/c2-1(3)4 | |||
| CAS-nummer | 7784-35-2 | |||
| PubChem | 24571 | |||
| Wikidata | Q425213 | |||
| Beschrijving | Kleurloze olieachtige vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H301 - H311 - H331 | |||
| P-zinnen | P261 - P264 - P270 - P271 - P280 - P301+P310 - P302+P352 - P304+P340 - P311 - P312 - P321 - P322 - P330 - P361 - P363 - P403+P233 - P405 - P501 | |||
| EG-Index-nummer | 232-060-0 | |||
| VN-nummer | R4I21S44T9 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | Vloeistof | |||
| Kleur | KLeurloos | |||
| Dichtheid | (0 °C)[1] 2,666 g/cm³ | |||
| Smeltpunt | -8,5 °C | |||
| Kookpunt | 60,4 °C | |||
| Oplosbaarheid in water | Ontleed | |||
| Goed oplosbaar in | Ethanol, Ether, Benzeen, Ammonia | |||
| Thermodynamische eigenschappen | ||||
| ΔfH | -821,3 kJ/mol | |||
| Nutritionele eigenschappen | ||||
| Type additief | eeft | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Arseen(III)fluoride is een chemische verbinding van arseen en fluor met de formule . Het is een heldere, kleurloze vloeistof die makkelijk met water(damp) reageert.[2]
Synthese en eigenschappen
kan verkregen worden uit de reactie van waterstoffluoride met arseen(III)oxide:[2]
Zowel als vaste stof en in de gasfase heeft het molecuul de structuur van een driezijdige piramide.[2] In de gasfase is de bindingslengte tussen arseen en fluor 170,6 pm, de F-As-F bindingshoek is 96,2°.[3]
Arseen(III)fluoride wordt als fluoriderend reagens toegepast om niet-metaalchlorides om te zetten in de overeenkomstige fluorides. Voor dit doel is het echter minder reactief dan het verwante antimoon(III)fluoride .[2]
Zouten met als anion zijn bekend met en als voorbeelden.[4] In het kaliumzout , gesynthetiseerd uit en bevat het ion én het neutrale molecuul , waarbij er ook een aantoonbare interactie is tussen neutraal molecuul en anion.[5]
Arseen(III)fluoride reageert met antimoon(V)fluoride. Het product kan zowel beschreven worden als de ionogene stof of als een neutraal adduct . De kristalstructuur vertoont aspecten van beide beschrijvingen, met de conclusie dat de waarheid, letterlijk, in het midden ligt.[6]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Arsenic trifluoride op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ New alkali metal and tetramethylammonium tetrafluoroarsenates(III), their vibrational spectra and crystal structure of caesium tetrafluoroarsenate(III) Klampfer P, Benkič P, Lesar A, Volavšek B, Ponikvar M, Jesih A., Collect. Czech. Chem. Commun. 2004, 69, 339-350 DOI:10.1135/cccc20040339
- ↑ Alkali-metal heptafluorodiarsenates(III): their preparation and the crystal structure of the potassium salt, Edwards A.J., Patel S.N., J. Chem. Soc., Dalton Trans., 1980, 1630-1632, DOI:10.1039/DT9800001630
- ↑ Fluoride crystal structures. Part XV. Arsenic trifluoride–antimony pentafluoride, Edwards A. J., Sills R. J. C. J. Chem. Soc. A, 1971, 942 - 945, DOI:10.1039/J19710000942






![{\displaystyle {\ce {Cs[AsF4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a49e25dc16dd56c9324aaaa06f6df53d99253e6)
![{\displaystyle {\ce {[(CH3)4N]^{+}[AsF4]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e5cb41d81b2a64a196008a9e8bcf71d01a0de53)


![{\displaystyle {\ce {[AsF2]^{+}[SbF6]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d08dd0f228a66e0f42e2da180eef974c1d455b70)









