Chloroplast-DNA
eiwitten
Het chloroplast-DNA, afgekort als cpDNA, is een klein circulair DNA-molecuul dat vrij voorkomt in het stroma van een chloroplast.[1] Het bestaan ervan werd voor het eerst aangetoond in 1962.[2] Door middel van DNA-sequencing werd in 1986 de nucleotidenvolgorde van chloroplast-DNA uit een levermos en tabaksplant bepaald.[3] Sindsdien zijn van honderden plantensoorten de cpDNA-sequenties vastgesteld, voornamelijk van zaadplanten en enkele algensoorten.[a]
De genomen van chloroplasten zijn sterk geconserveerd; ze hebben gedurende de evolutie weinig mutaties geaccumuleerd en verschillen dus nauwelijks tussen plantengroepen. Hierdoor zijn ze uiterst geschikt voor fylogenetisch onderzoek. Het cpDNA is relatief eenvoudig uit de chloroplast te isoleren, omdat er vaak meerdere cpDNA-moleculen in het stroma aanwezig zijn. Het exacte aantal kopieën hangt af van het ontwikkelingsstadium. Mesofylcellen in jonge bladeren kunnen wel 100 exemplaren van het genoom bevatten.
Het chloroplast-DNA is een sterke aanwijzing voor de endosymbiosetheorie. Volgens de endosymbiosetheorie zijn chloroplasten fotosynthetiserende prokaryoten die in een voorouderlijke eukaryotische cel zijn gaan leven. Het cpDNA zoals men dat nu in chloroplasten aantreft komt sterk overeen met dat van de prokaryote voorouders: ze zijn klein, circulair en vormen geen complexe structuren zoals chromatine. Het cpDNA codeert verschillende eiwitten en functionele RNA-moleculen, die voornamelijk betrokken zijn de fotosynthese.[b] Veel van de genen zijn georganiseerd in clusters (operons). Transcriptie van deze operons levert grote polycistronische mRNA-transcripten, die later worden opgesplitst in oligo- of monocistronische mRNA’s. Deze manier van genexpressie vindt men alleen terug in bacteriën.
Moleculaire structuur


XXXXXXXXXXs
xxxxxxxxx
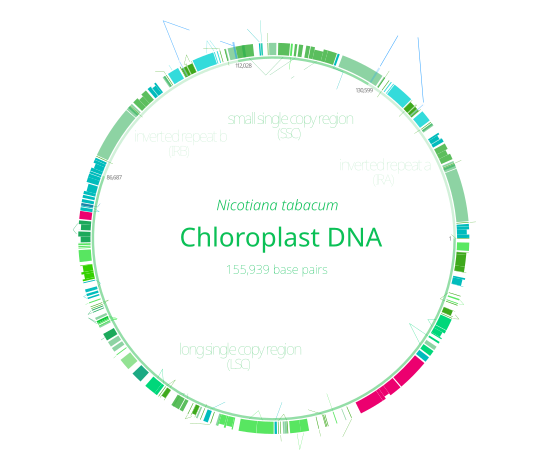
Het erfelijk materiaal van chloroplasten ligt vrij in de chloroplast en is circulair (covalent gesloten ring). Het heeft een lengte van ongeveer 120.000 tot 170.000 basenparen, en bevat meestal 120–130 genen. Dit zijn slechts kleine aantallen in vergelijking met genomen van veel tegenwoordig levende bacteriën, en ook met de genomen van hun cyanobacteriële voorouders.[5] Een cpDNA-molecuul is gemiddeld 30–60 micrometer in omtrek en heeft een moleculaire massa van 80–130 miljoen dalton.[6]
De meeste chloroplasten organiseren hun genoom in één ringvormig DNA-molecuul. Een uitzondering hierop is het cpDNA van de dinoflagellaten, waarvan het genoom in veertig kleine plasmiden is opgedeeld, elk 2000 tot 10.000 basenparen lang. Deze miniplasmiden bevatten slechts 1 tot 3 genen,[4] maar er zijn ook 'lege' plasmiden gevonden die geen coderend DNA dragen.
Chloroplasten in jonge bladeren bevatten ongeveer honderd kopieën van hun genoom. Dit aantal neemt af tot 50–20 kopieën in oudere bladeren. De cpDNA-ringen zijn gewoonlijk geclusterd in zogenaamde nucleoïden. In een chloroplast komen meerdere nucleoïden voor die willekeurig zijn verspreid door het stroma.[c] Het cpDNA van de nucleoïden is niet gespiraliseerd rond histonen,[8] maar in sommige roodwieren zijn wel histonachtige eiwitten ontdekt die het DNA enigszins bij elkaar houden.[7]
Inverted repeats
Het chloroplast-DNA van de meeste planten bestaat uit vier onderscheiden gebieden. Twee inverted repeats (IR's) van 20.000–28.000 basenparen lang verdelen de rest van het DNA in een large single copy-regio (LSC) van 80.000–90.000 basenparen lang en een small single copy-regio (SSC) van 16.000–27.000 basenparen lang.[9] De inverted repeats variëren in lengte. In landplanten hebben inverted repeats vaak een lengte van 20.000 tot 25.000 basenparen. De inverted repeat-regio's bevatten gewoonlijk drie ribosomaal RNA-genen en twee tRNA-genen. Ze kunnen echter ook groter zijn en wel 150 genen bevatten.[4]
Lineaire structuur
Chloroplast-DNA wordt door biologen over het algemeen beschouwd als ringvormig, maar sommige onderzoeken suggereren dat cpDNA ook een lineaire vorm aan kan nemen,[10] zoals het chromosomaal DNA in eukaryoten. Bij meer dan 95% van het cpDNA in maïs-chloroplasten heeft men ontdekt dat het niet gaat om individuele ringen, maar om een vertakte lineaire vorm.[4]
DNA-replicatie

De manier waarop het chloroplast-DNA gerepliceerd wordt is nog niet volledig ontrafeld. Vanaf de jaren 70 van de twintigste eeuw hebben onderzoekers geprobeerd het replicatieproces te volgen door middel van elektronenmicroscopie.[11][12] Resultaten van deze onderzoeken wijzen op het feit dat het cpDNA zich repliceert door middel van een zogenaamde dubbele D-loop (displacement loop). Replicatie begint op een specifiek replicatiestartpunt, het punt waar het dubbelstrengs DNA uit elkaar gaat. Daar openen zich meerdere replicatievorken, waardoor de replicatiemachinerie het DNA kan kopiëren.
Het bovenbeschreven model wordt ondersteund door het feit dat in het cpDNA veel deaminering van nucleotiden optreedt.[11] Deaminering is het proces waarin een aminogroep van een molecuul wordt verwijderd, wat bij het cpDNA-nucleotiden resulteert in de verandering van een stikstofbase. Wanneer bijvoorbeeld adenine wordt gedeamineerd, verandert het in de bijzondere base hypoxanthine. Hypoxanthine kan basenparen met cytosine, en wanneer deze cytosine wordt gerepliceerd, zal er een C–G-basenpaar ontstaan. Zo muteert een adenine door deaminering in een guanine (A → G).
DNA is alleen vatbaar voor deaminering wanneer het enkelstrengs is. Wanneer er replicatievorken ontstaan, zijn de DNA-strengen enige tijd enkelstrengs. De nucleotiden zijn dan een bepaalde tijd kwetsbaar voor deaminering. Doordat het DNA tijdens replicatie in een vloeiende lijn weer dubbelstrengs wordt, ontstaat een "A → G"-gradiënt in de richting van het replicatiestartpunt. De hoogste mate van deaminering gebeurt waarschijnlijk het dichtst bij het replicatiestartpunt omdat deze nucleotiden het langst enkelstrengs waren. Een tweede theorie gaat daarentegen uit van een lineair cpDNA-molecuul dat repliceert door middel van homologe recombinatie.[13] Deze theorie krijgt minder aanhang omdat het niet verklaart waarom het chloroplast-DNA "A → G"-gradiënten bevat.
Genetische inhoud
Het chloroplast-DNA van hogere planten codeert voor ongeveer 120 verschillende eiwitten en functionele RNA-moleculen.[14][15] De eiwitten die in chloroplasten worden geproduceerd zijn betrokken bij de fotosynthese (fotosystemen, cytochromen en ATP-synthetase), en bij transcriptie (RNA-polymerase) en translatie (tRNA en r-eiwitten). De genen zijn georganiseerd in operons. In tegenstelling tot andere prokaryotische genomen bevat het cpDNA echter ook introns.[16]
Het cpDNA van landplanten codeert voor vier rRNA-moleculen, 30 tot 31 tRNA-moleculen, 21 ribosomale eiwitten en vier subunits van RNA-polymerase, allen betrokken bij eiwitsynthese die in het stroma plaatsvindt.[17] De ribosomen van chloroplasten lijken sterk op die van prokaryoten.[18] Het chloroplast-DNA codeert daarnaast voor 28 thylakoïd-eiwitten, een Rubisco-subunit en voor eiwitcomplexen die betrokken zijn in de elektronentransportketen, vergelijkbaar met NADH-dehydrogenase.[19]
Een groot deel van de eiwitten die binnen de chloroplast aanwezig zijn worden niet gecodeerd door het chloroplast-DNA, maar door het kern-DNA. Van de ruwweg 3000 verschillende eiwitten die in chloroplasten zijn aangetroffen, wordt ongeveer 95% gecodeerd door chromosomale genen (genen uit de celkern). Dit neemt niet weg dat het cpDNA essentieel is voor het tot uiting brengen van correct functionerende chloroplastcomponenten. Eiwitcomplexen in chloroplasten worden namelijk opgebouwd uit subunits die zowel van het cpDNA als het DNA van de gastheercel afkomstig zijn. De eiwitsynthese tussen de chloroplast en de kern moet hierdoor strikt gecoördineerd worden. Controle wordt over het algemeen geregeld vanuit de kern: signaalmoleculen uit de celkern reguleren de genexpressie van het cpDNA. Chloroplasten kunnen echter ook signalen afgeven die genexpressie in de kern reguleren. Men noemt dit retrograde signaling.[20]
Genoverdracht
Gedurende de evolutionaire ontwikkelingsgeschiedenis van de chloroplast zijn fragmenten DNA van het chloroplastgenoom overgedragen naar het kern-DNA van de gastheercel,[2][21] een proces genaamd endosymbiotische genoverdracht. Als gevolg hiervan is de genoomgrootte van de chloroplast sterk teruggedrongen vergeleken met die van vrijlevende cyanobacteriën. Chloroplasten bevatten vaak 60–100 genen, terwijl cyanobacteriën vaak meer dan 1500 genen in hun genoom dragen.[22] Er zijn slechts enkele gevallen bekend van genoverdracht naar de chloroplast.[23][24]
Endosymbiotische genoverdracht heeft licht geworpen op de evolutie van Chromalveolata: organismen die nakomelingen zijn van de secundaire endosymbiose tussen een roodalg en een bikont. Veel van deze organismen hebben hun chloroplasten ergens in de evolutionaire geschiedenis van symbiose verloren. Wat echter niet verloren is gegaan zijn de genen die de chloroplast aan de gastheer heeft overgedragen. Die genen vormen bewijsmateriaal voor het bestaan van een chloroplast in een voormalig endosymbiotisch stadium. Zo beschikken hedendaagse diatomeeën over een chloroplast die van roodwieren afstamt, maar het DNA in de kern van de diatomee bevat genen die afkomstig zijn van groenwier-chloroplasten. Dit is een sterke aanwijzing dat de voorouderlijke diatomeeën een groenalg-chloroplast hadden opgenomen, die pas later werd vervangen door roodalg-chloroplast.[25]
In landplanten kan 11–14% van het kern-DNA genetisch herleid worden naar het chloroplastgenoom.[26] In Arabidopsis is dit zelfs 18%, wat overeenkomt met 4500 eiwitcoderende genen.[27] Er zijn maar weinig recente gevallen bekend waarin het chloroplastgenen naar het kerngenoom in landplanten wordt overgedragen.
Verwerking van RNA
Het cpDNA wordt in de chloroplast overgeschreven naar een mRNA-molecuul. Dit mRNA zal, voordat het getransleerd wordt naar een eiwit, in het stroma worden verwerkt (processing). Daarbij worden er nucleotiden toegevoegd (insertie), verwijderd (deletie) en vervangen (substitutie). Het stroma van de chloroplast is een uiterst oxidatieve omgeving, waardoor de kans groot is dat in het mRNA mutaties ontstaan. RNA-verwerking wordt gebruikt om deze mutaties te repareren en functionele sequenties te conserveren. Vaak gaat het om het herstel van een stop- of startcodon.[28]
Het mechanisme van RNA-bewerking is nog niet volledig opgehelderd. Onderzoek suggereert dat er honderden verschillende PPR-eiwitten (van het kerngenoom) betrokken zijn bij de verwerking van RNA in plastiden. Deze eiwitten bestaan uit 35 aminozuren en binden aan de cis-zijde van het mRNA-transcript.[28] Lagere landplanten zoals levermossen, mossen en varens hebben honderden verschillende plaatsen in hun RNA waar RNA-verwerking kan plaatsvinden. Hogere plantensoorten hebben er meestal dertig tot veertig. Parasitaire planten zoals Epifagus virginiana hebben RNA-verwerking verloren en kunnen daarom geen fotosynthese uitvoeren.[29]
Eiwittransport en regulatie
 Zie ook Eiwitlokalisatie
Zie ook EiwitlokalisatieDe overdracht van genen uit het cpDNA naar het kern-DNA heeft tot gevolg gehad dat veel eiwitten die nodig zijn in de chloroplast getransleerd worden in het cytoplasma. Dit betekent dat deze eiwitten gericht getransporteerd moeten worden naar de chloroplast, waarbij ze in ieder geval twee chloroplastmembranen zullen passeren.[30] Tijdens de endosymbiose van chloroplasten, beschikte de cel al over mitochondriën en peroxisomen, waardoor de chloroplast een eigen eiwitlokalisatiesysteem moest ontwikkelen.[30]
Gedurende de evolutie van chloroplasten zijn veel eiwitten die worden gecodeerd door overgedragen cpDNA-genen van functie veranderd. Ze zijn bijvoorbeeld betrokken geworden bij de celdeling en cellulaire afweer. Sommigen worden geleid naar een secretoir traject.[22] Hierbij moet worden opgemerkt dat sommige chloroplasten door secundaire endosymbiose worden omgeven door een celmembraan die nog afkomstig is van de gastheercel, en zich dus topologisch gezien buiten de cel bevinden, en om naar deze chloroplast te komen moet het eiwit dus een celmembraan passeren. In een dergelijke situatie volgen de eiwitten een secretoir traject, net zoals ze dat doen wanneer ze naar de extracellulaire matrix zouden gaan.[31]
N-terminale transit-sequenties
Polypeptiden, lange ketens van aminozuren, worden na de translatie gevouwen tot functionele eiwitten. De twee uiteinden van het polypeptide noemt men de N-terminus (het amino-eind) en de C-terminus (het carboxyl-eind). Aan veel chloroplast-eiwitten die gecodeerd worden in de celkern, worden specifieke signaalpeptides (cleavable transit peptides) aan de N-terminus van het polypeptide gehecht, die kunnen worden herkend door transporteiwitten. Zij voeren het gesynthetiseerde eiwit naar de chloroplast.[30][32] De transit-sequenties worden ook wel presequenties genoemd, omdat ze zich aan het "voorste" uiteinde van een polypeptide bevinden.[d]
De transit-sequenties die aan polypeptiden worden toegevoegd variëren enorm in lengte:[32] ze kunnen 20 tot wel 150 aminozuren lang zijn.[30] Deze ongebruikelijk lange lengte suggereert dat transit-peptiden bestaan uit meerdere domeinen met verschillende functies. Transit-peptiden zijn gewoonlijk positief geladen, rijk aan gehydroxyleerde aminozuren zoals serine, threonine en proline, en bevatten maar weinig zure aminozuren zoals asparaginezuur en glutaminezuur.[30]
Niet alle chloroplast-eiwitten krijgen een N-terminale transit-sequentie aan hun keten toegevoegd.[30] Bij sommige bevindt het signaalpeptide zich al in de functionele structuur van het eiwit zelf. Andere ontvangen hun transit-sequentie juist aan de C-terminus.[33] De meeste onderzochte eiwitten die geen transit-sequenties bevatten worden verstuurd naar het buitenmembraan van de chloroplast.[30]
Zie ook
Noten
Referenties
|











