Kwasy
 | Ten artykuł dotyczy związków chemicznych. Zobacz też: inne znaczenia tego słowa. |
 | Ten artykuł od 2021-02 zawiera treści, przy których brakuje odnośników do źródeł. Należy dodać przypisy do treści niemających odnośników do źródeł. Dodanie listy źródeł bibliograficznych jest problematyczne, ponieważ nie wiadomo, które treści one uźródławiają. Sprawdź w źródłach: Encyklopedia PWN • Google Books • Google Scholar • Federacja Bibliotek Cyfrowych • BazHum • BazTech • RCIN • Internet Archive (texts / inlibrary) Dokładniejsze informacje o tym, co należy poprawić, być może znajdują się w dyskusji tego artykułu. Po wyeliminowaniu niedoskonałości należy usunąć szablon {{Dopracować}} z tego artykułu. |
Kwasy – związki chemiczne wykazujące charakter kwasowy, co w zależności od definicji może oznaczać zdolność do:
- zakwaszania środowiska, tj. obniżania jego pH (definicja Arrheniusa),
- dostarczania kationów wodorowych (definicja Brønsteda-Lowry’ego),
- przyjmowania pary elektronowej (definicja Lewisa).
W najprostszym rozumieniu kwasy to związki chemiczne zawierające łatwo dysocjujące atomy wodoru. W roztworach wodnych dysocjują one na kation wodorowy i anion reszty kwasowej. Związki chemiczne o właściwościach przeciwnych do kwasowych to zasady.
Kwas klasyczny
 Osobny artykuł: Teoria Arrheniusa.
Osobny artykuł: Teoria Arrheniusa.
Kwas według klasycznej definicji Arrheniusa to każdy związek, który wprowadzony do roztworu wodnego zwiększa stężenie jonów oksoniowych H3O+ (zmniejsza pH roztworu). Automatycznie zasadą jest każdy związek, który zwiększa stężenie jonów wodorotlenkowych OH−. Definicja ta ma głównie zastosowanie do roztworów wodnych.
W wyniku reakcji kwasów z zasadami powstają zazwyczaj sole.
Kwas Brønsteda-Lowry’ego
 Osobny artykuł: Teoria kwasów i zasad Brønsteda.
Osobny artykuł: Teoria kwasów i zasad Brønsteda.
Według teorii kwasów i zasad Brønsteda-Lowry’ego, kwas to każdy związek chemiczny, który w warunkach danej reakcji jest donorem, czyli inaczej dostarczycielem jonu wodorowego H+.
Z drugiej strony zasada to każdy związek chemiczny, który może być akceptorem, czyli inaczej przyjmującym jon wodorowy. W reakcji kwasu i zasady Brønsteda-Lowry’ego powstaje nowy kwas i nowa zasada. Np. w reakcji:
- HA + B ⇌ A− + HB+
Związek HA jest kwasem a związek B zasadą. Jon A− jest nową zasadą, a HB+ nowym kwasem.
Przykład reakcji:
- H2O + NH3 ⇌ OH− + NH+4
Związki chemiczne (z wyjątkiem niektórych bardzo mocnych zasad i kwasów) mogą w zależności od warunków pełnić rolę kwasu lub zasady.
Kwas Lewisa
 Osobny artykuł: Teoria kwasów i zasad Lewisa.
Osobny artykuł: Teoria kwasów i zasad Lewisa.
Inną, bardziej ogólną definicję kwasu podał Gilbert Lewis: kwas to związek chemiczny, który jest akceptorem (przyjmującym) w warunkach danej reakcji parę elektronową (więc zasada jest donorem pary elektronowej).
Definicja nie obejmuje klasycznych kwasów (tj. kwasów protonowych np. HCl), które według teorii Brønsteda-Lowry'ego są kwasami, w myśl definicji Lewisa kwasami nie są. Stanowią one zaś addukty kwasowo-zasadowe.
Definicja Lewisa obejmuje natomiast związki chemiczne, które zachowują się jak kwasy, bo mają silny deficyt elektronów, mimo że w ogóle nie posiadają w swojej strukturze atomu wodoru (np. chlorek glinu). Związki są nazywane kwasami Lewisa.
W przypadku zasad, definicje Lewisa i Brønsteda-Lowry’ego praktycznie się pokrywają – tzn. nie istnieją takie związki, które by były zasadami według definicji Lewisa, a nie były nimi według definicji Brønsteda-Lowry’ego.
Jeszcze bardziej ogólnym od kwasów i zasad Lewisa podziałem związków chemicznych pod kątem nadmiaru lub deficytu elektronów są pojęcia elektrofila i nukleofila.
Wybrane kwasy
- Wybrane tlenowe kwasy nieorganiczne
- kwas azotowy (azotowy(V)), HNO3
- kwas azotawy (azotowy(III)), HNO2
- kwas siarkowy (siarkowy(VI)), H2SO4
- kwas siarkawy (siarkowy(IV)), H2SO3
- kwas nadtlenodisiarkowy, H2S2O8
- kwas fosforowy (fosforowy(V)), H3PO4
- kwas fosfonowy (fosforawy, fosforowy(III)), H3PO3
- kwas węglowy, H2CO3
- kwas podchlorawy, (chlorowy(I)) HClO
- kwas chlorawy (chlorowy(III)), HClO2
- kwas chlorowy (chlorowy(V)), HClO3
- kwas nadchlorowy (chlorowy(VII)), HClO4
- kwas borowy, H3BO3
- Wybrane beztlenowe kwasy nieorganiczne
- kwas fluorowodorowy, HFaq
- kwas chlorowodorowy (solny), HClaq
- kwas bromowodorowy, HBraq
- kwas jodowodorowy, HIaq
- kwas siarkowodorowy, H2Saq
- kwas cyjanowodorowy, HCNaq
- Wybrane kwasy organiczne
- kwasy karboksylowe:
- kwas mrówkowy, HCOOH
- kwas octowy, CH3COOH
- kwas szczawiowy, (COOH)2
- kwas benzoesowy, PhCOOH
- kwas mlekowy, CH3CH(OH)COOH
- kwas cytrynowy, HOOC−CH2−C(OH)(COOH)−CH2−COOH
- kwasy organiczne niezawierające grupy karboksylowej:
- fenole, np. kwas pikrynowy, C6H2(NO2)3OH
- kwas moczowy,
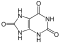
- kwasy hydroksamowe, RC(=O)NHOH
- kwasy organiczne zawierające resztę kwasu nieorganicznego:
- kwas p-toluenosulfonowy, CH3−C6H4−SO3H
- kwas decylofosfonowy, CH3(CH2)9−PO3H2
- kwas deoksyrybonukleinowy (DNA) i kwasy rybonukleinowe (RNA) – poli(diestry kwasu fosforowego)
Zobacz też
 | Zobacz hasło kwas w Wikisłowniku |
Linki zewnętrzne
- Teorie kwasów i zasad. chemorganiczna.com. [zarchiwizowane z tego adresu (2008-07-05)].
- p
- d
- e
| |
| Typy kwasów | |
|---|---|
| Typy zasad |
|
- Britannica: science/acid
- SNL: syrer
- Catalana: 0219424











